Procesos fisiológicos respiratorios de pacientes en estado crítico
Ventilación
Índice de Contenido
Consiste en el proceso mecánico que permite hacer llegar aire desde el exterior a los alveolos pulmonares. En este proceso juegan un papel crucial toda la estructura muscular respiratoria, la vía aérea y el control neurológico central por parte del centro respiratorio. El aire penetra en la caja torácica como consecuencia de la diferencia de presiones entre el exterior y los pulmones, que continuamente tienen una tendencia al colapso (debido a la tensión superficial alveolar -contrarrestada por el surfactante- y a la estructura elástica del parénquima pulmonar). Como fuerzas opositoras a esta tendencia natural de los pulmones, emergen el diafragma y resto de musculatura respiratoria, así como la envoltura pleural. La elasticidad pulmonar (compliance) resulta, pues, de poner en relación el volumen pulmonar (ml) y la presión en cada momento (cm H2O). Como resultado de todo ello, el aire atmosférico tiende a penetrar en la vía aérea y expandirse hasta los alveolos. Posteriormente, durante la espiración el proceso es inverso, aunque con mayor pasividad y menor demanda muscular. Del volumen total que entra en la vía aérea en cada inspiración (aproximadamente unos 500 ml), hay una fracción que no llega a los alveolos porque se queda en el espacio muerto anatómico (unos 150 ml) (Ver Imagen 1).
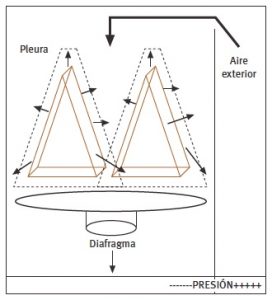 Imagen 1. Gradiente de presiones en la ventilación durante la fase inspiratoria
Imagen 1. Gradiente de presiones en la ventilación durante la fase inspiratoria
Intercambio gaseoso
Es el proceso que tiene lugar a nivel de la membrana alveolo-capilar mediante gradiente de presiones a través de la misma. Se denomina difusión al paso de gases a través de la membrana alveolo-capilar desde las zonas de mayor concentración de gases a la de menor. En condiciones normales, esta membrana es tan delgada que no es obstáculo para el intercambio, los eritrocitos hacen su paso por la zona del capilar en contacto con el alveolo de uno en uno debido a la extrema delgadez del capilar y antes de que haya sobrepasado el primer tercio de este territorio ya se ha realizado perfectamente el intercambio gaseoso, pero en algunas enfermedades pulmonares como el síndrome de distrés respiratorio agudo del adulto (SDRA), enfermedad aguda pulmonar (EAP), etc., esta membrana se altera y entorpece, en distinto grado, el paso de gases, por tanto, los trastornos de la difusión es una de las causas de hipoxemia.
El aire que llega a los alveolos contiene O2, argón, nitrógeno, etc., cuya presión total suma 760 mmHg a nivel del mar. Para alcanzar este valor de presión, cada gas ejerce su presión parcial correspondiente: la fracción inspiratoria de oxígeno (FiO2), que supone un 21% del total del aire, genera una presión de 149 mmHg, descontado el efecto de la saturación de vapor de agua procedente de la mucosa respiratoria. El CO2 contenido en los alveolos pulmonares procedente de los capilares ejerce una presión de 40 mmHg; por tanto, la presión final alveolar de oxígeno será de unos 109 mmHg, ya que el resto se intercambia por la presión ejercida por el CO2. Así, las presiones finales a ambos lados de la membrana alveolo-capilar serán las que se muestran en la Imagen 2.
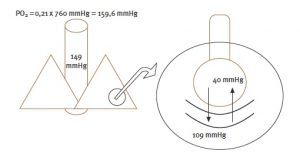 Imagen 2. Gradientes de presiones desde el exterior hasta el capilar pulmonar
Imagen 2. Gradientes de presiones desde el exterior hasta el capilar pulmonar
Con motivo de la variabilidad que se produce a lo largo del territorio vascular, la presión de O2 y CO2 en el lecho arterial oscilará en torno a estos valores:
PaO2: 85-100 mmHg
PCO2: 35-45 mmHg
Para garantizar un intercambio gaseoso adecuado, es necesario asegurar un flujo sanguíneo apropiado al territorio alveolar. El término perfusión se refiere al riego sanguíneo pulmonar. La circulación pulmonar se inicia en el ventrículo derecho, donde nace la arteria pulmonar. Esta arteria se divide en dos ramas pulmonares, cada una de ellas se dirige hacia un pulmón. Estas ramas pulmonares se van dividiendo a su vez en ramas más pequeñas para formar finalmente el lecho capilar que rodea a los alveolos, siendo este en su comienzo arterial y luego venoso. Del lecho venoso parte la circulación venosa que termina en las cuatro venas pulmonares, las cuales desembocan en la aurícula izquierda. Hay que hacer una salvedad: el sistema no es un dispositivo hermético y totalmente eficiente, parte de la sangre es derivada a territorios capilares que no se ponen en contacto con los alveolos -el grupo de venas bronquiales profundas que se drenan en las venas pulmonares, junto con las venas de Tebesio-. Esto hace que la sangre pase directamente con las mismas presiones con las que llegó al pulmón hasta el ventrículo izquierdo, donde se mezclará toda la sangre, aquella que ha podido ser bien oxigenada y aquella otra que por múltiples razones no se ha enriquecido adecuadamente de O2. A este porcentaje de sangre no oxigenada se le denomina shunt fisiológico o anatómico.
La relación ventilación/perfusión (V/Q) da una clara información sobre el funcionamiento general del sistema. Como ejemplo se pueden referir valores estándares: un adulto sano de talla media presenta unos valores de en torno a 4,2 ml/min de ventilación y entre 4 y 5 l/min de flujo pulmonar, por lo que sus valores medios de V/Q oscilarán entre 0,8 y 1.
Si el gasto cardiaco se hace insuficiente -es decir, cae Q-, los tejidos suplen la menor entrega con una mayor extracción de oxígeno de la sangre arterial que les llega. Esta situación se refleja en una disminución de la tensión o presión parcial de oxígeno de la sangre venosa que retorna a los pulmones (PvO2); la PvO2 aparecerá entonces disminuida y por debajo de sus valores normales de 40 mmHg a nivel del mar, que corresponde a una saturación de oxígeno aproximadamente del 75%. La PvO2 es una determinación valiosa, por cuanto es directamente proporcional a la entrega de oxígeno e inversamente proporcional a la demanda o consumo metabólico, ya que disminuirá también ante situaciones de elevado consumo metabólico.
La combinación de las posibles situaciones de ventilación y perfusión es lo que se conoce como relación V/Q y se representa en la Imagen 3.
 Imagen 3. Relación V/Q
Imagen 3. Relación V/Q
Esta relación nunca es perfecta, ya que la ventilación es heterogénea en distintas zonas de los pulmones, siendo su valor habitual en situación de normalidad de 0,8. En caso de unidades alveolares poco ventiladas, se produciría una situación de shunt, con paso de sangre no oxigenada al territorio arterial. Del mismo modo, unidades a las que no llega la perfusión suficiente se convierten en espacio muerto fisiológico, ya que se pierde su capacidad intercambiadora de gases.
El gradiente alveolo-arterial de O2 (AapO2) mide la diferencia existente entre los valores de pO2 alveolar (PAO2) y arterial (PaO2) y permite obtener una aproximación del estado de ventilación-perfusión. Valores alterados sugieren una variación del parénquima pulmonar; por el contrario, valores normales de AapO2 en presencia de hipoxia e hipercapnia son compatibles con hipoventilacion alveolar. Su cálculo se establece mediante la ecuación del gas alveolar:
PAO2 = PiO2 – [PaCO2 (F1O2 + [(1 – FiO2)/R])]
PiO2: pO2 inspirada
FiO2: fracción inspiratoria de O2 (aire ambiente: 0,21)
R: VCO2/VO2
El sistema de transporte sanguíneo de gases está determinado por la presión del O2 disuelto en plasma (pO2), por la capacidad de transporte de la hemoglobina y por la presión arterial de CO2. La pO2 representa una fracción mínima del oxígeno en sangre (un 2% o 3% aproximadamente), yendo la mayor parte del mismo ligada a los grupos HEM de la hemoglobina, saturando el hematíe hasta un máximo de 1,34 ml de O2 (saturación de oxígeno del 100%). La cantidad total de oxígeno en sangre (CaO2) corresponde a la suma de O2 transportado en sangre (pO2) y el O2 unido a Hb (SO2):
CaO2 = (SatO2 x 1,34 x Hb) + (0,003 x pO2)
Se expresa en volúmenes por cien (vols%) y en sujetos sanos su valor es de 20 vols%.
Existe una relación entre la pO2 y la SatO2, establecida mediante la curva de disociación de la hemoglobina, la cual representa la capacidad de la unión de la hemoglobina al oxígeno. En los tramos superiores, la hemoglobina tiene una gran afinidad por la captación de oxígeno, debido a la elevación de la pO2, y es la que se presenta en el lecho arterial. En los tramos inferiores de la curva, la hemoglobina pierde afinidad por el oxígeno, lo que facilita la captación de este por parte de los tejidos, gracias a la baja pO2. Habitualmente se utiliza el parámetro denominado p50 para referenciar la cifra de pO2 que corresponde a un valor de SatO2 del 50% a 37º C, y una pCO2 de 40 mmHg y pH de 7.4. En adultos sanos ronda los 26-28 mmHg. Si los valores de SO2% se sitúan en la porción plana (valores superiores al 85%) pueden producirse notables cambios en la pO2 sin que apenas varíe el correspondiente valor de SO2%.
Esta curva puede desplazarse hacia arriba en presencia de hipotermia, hipocapnia, alcalosis o disminución del 2-3 DPG; por el contrario, se desplaza hacia abajo (mayor disociación O2-Hb) en situaciones de hipertermia, hipercapnia, acidosis o alcalosis y aumento de 2-3 DPG (Ver Imagen 4).
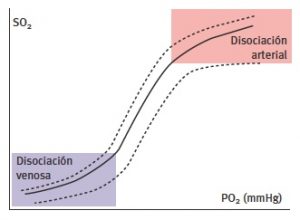 Imagen 4. Curva de disociación de la hemoglobina
Imagen 4. Curva de disociación de la hemoglobina
El resultado final de todos los procesos descritos puede resumirse en el esquema que se representa en la Imagen 5.
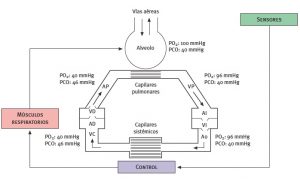 Imagen 5. Presiones de los gases a distintos niveles y circuito de perfusión
Imagen 5. Presiones de los gases a distintos niveles y circuito de perfusión
Equilibrio ácido-base
Gracias a la ecuación de Henderson-Hasselbalch se puede determinar cómo influye el mecanismo tampón de amortiguación en situaciones de alteración del equilibrio ácido-base. Así, mediante un proceso reversible, el exceso de hidrogeniones se amortigua mediante la acción del bicarbonato (proceso regulado por el riñón), ya que se transforma en dióxido de carbono (que puede ser eliminado mediante la espiración pulmonar) y agua:
(H+) + HCO3↔ H2CO3 ↔ CO2 + H2O
La relación entre el pH, bicarbonato y dióxido de carbono sería:
pH = pK + log (HCO3/PaCO2)
Mediante la medición de gases en una muestra de sangre arterial pueden interpretarse muchos valores de los mencionados, así como un análisis de la situación de regulación del pH corporal. Los valores normales son:
- pH: 7,35-7,45.
- pO2: 80-100 mmHg.
- pCO2: 35-45 mmHg.
- HCO3-: 22-26 mmHg.
- Eb: -3/+3.
La combinación de estos parámetros y los mecanismos de compensación producen situaciones como las que se representan en la Tabla 1 e Imagen 6.
 Tabla 1. Mecanismos de compensación
Tabla 1. Mecanismos de compensación
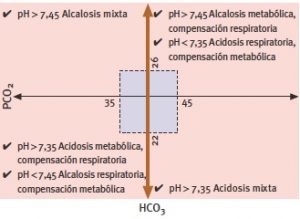 Imagen 6. Equilibrio ácido-base y mecanismos de compensación renal y pulmonar
Imagen 6. Equilibrio ácido-base y mecanismos de compensación renal y pulmonar
Se debe resaltar la importancia de una obtención y manipulación adecuadas de la muestra de sangre arterial, ya que los valores se alteran rápidamente. El tiempo transcurrido entre la extracción de la muestra y su procesamiento en laboratorio no debe ser superior a 10 o 15 minutos ya que, pasado dicho tiempo, el metabolismo eritrocitario consume O2 y produce CO2, con lo cual se alteran las presiones de ambos gases en la muestra (Rodríguez-Roisín et al, 1998). En caso de prolongarse este tiempo, es necesario almacenar la muestra en hielo triturado para frenar este proceso (Liss y Payne, 1993), aunque no debiera alargarse por encima de treinta minutos (Mesa Pérez, 2001). Algunos estudios han demostrado que no es recomendable esta práctica en jeringas de polipropileno (las habitualmente empleadas en el medio hospitalario) por la influencia que tiene en la pO2 (Guevara et al, 2002).
En DAE formación disponemos de una amplia gama de oferta formativa, concretamente en cursos para enfermería CFC. Entre ellos el curso de cuidados enfermeros en pacientes críticos que cuenta con acreditación CFC válida a nivel nacional.













0 comentarios